- نویسنده : وحید مولایی
- بازدید : 147 مشاهده

برنامه های اساسی PCR در دندانپزشکی
وقتی جزئیات اصلی پروژه ژنوم انسانی در فوریه 2001 (کنسرسیوم بین المللی و سلومر ژنومیکس) اعلام شد ، شکی نیست که باعث طنین و هیجان زیادی در سراسر جهان شد. به گفته بسیاری از دانشمندان ، اتمام این پروژه به معنی پایان بسیاری از بیماری ها ، جلوگیری از بیماری هایی مانند سرطان و ایدز ، یا خلاص شدن از شر بیماری هایی مانند سرطان ، طولانی شدن عمر انسان و افزایش کیفیت زندگی بود.
هنگامی که جزئیات اصلی پروژه ژنوم انسانی در فوریه 2001 (کنسرسیوم بین المللی و سلومر ژنومیکس) اعلام شد ، شکی نیست که باعث طنین و هیجان زیادی در سراسر جهان شد. به گفته بسیاری از دانشمندان ، اتمام این پروژه به معنی پایان بسیاری از بیماری ها ، جلوگیری از بیماری هایی مانند سرطان و ایدز ، یا خلاص شدن از شر بیماری هایی مانند سرطان ، طولانی شدن عمر انسان و افزایش کیفیت زندگی بود. با این حال ، هنگامی که این پروژه با طرح کلی آن نهایی شد ، درک شد که مراحل بیشتری وجود دارد که باید از آن عبور کرد. با وجود کار روزمره ، ژنوم انسان همچنان راز خود را حفظ می کند.
پروژه ژنوم انسانی تاکنون گسترش های زیادی داشته است. یکی از آنها رمزگشایی از ژنوم موجودات زنده دیگر است که می تواند به عنوان الگویی برای ژنوم انسان و انجام تجزیه و تحلیل عملکردی ژن های مشترک یا قسمت های مشترک ژن ها باشد. بنابراین ، بدون نیاز به مطالعات کشت سلولی ، که امروزه نیز مورد بحث قرار می گیرد ، شاید تجزیه و تحلیل ژن ها با حفظ سیستم بیولوژیکی موجودات زنده بر روی این موجودات نمونه ارائه شود. برای این منظور ، تاکنون تجزیه و تحلیل ژنوم از گونه های مختلف مانند H. آنفلوانزا ، S. cerevisiae ، C. elegans ، D. melanogaster ، M. musculus انجام شده است.
ارتباط بین ژن ها و بیماری ها طیف گسترده ای از مطالعات را نه تنها در پزشکی و زیست شناسی ، بلکه در همه زمینه های علوم بهداشتی ایجاد کرده است.
پروژه ژنوم انسانی که از نظر بودجه پیشتاز کارهایی است که تاکنون انجام شده است ، همچنین به توسعه تکنیک های جدید مولکولی کمک کرده است که می تواند به نتایج جدید و دقیق تری منجر شود.
واکنش زنجیره ای پلیمراز (PCR)
PCR توسط كاری مولیس در سال 1983 ساخته شد و با كشف وی جایزه نوبل شیمی در سال 1993 به وی اعطا شد. سایکی و همکاران در سال 1985 ، آنها اولین انتشارات خود را با استفاده از این روش انجام دادند. از روز انتشار ، این روش در مطالعات مبتنی بر DNA یا RNA ، به ویژه در زمینه های زیست شناسی مولکولی ، ژنتیک ، پزشکی ، پزشکی قانونی و شیمی مورد استفاده قرار گرفته است و به تعداد باورنکردنی 90 مقاله در روز رسیده است ( 1)
روش PCR تکثیر (تقویت) DNA در شرایط آزمایشگاهی است. در عین حال ، سنتز DNA از مولکول RNA در شرایط خاص به راحتی قابل استفاده است. اجزای مورد نیاز در این زنجیره واکنش ها عبارتند از: DNA الگو (مولکول DNA برای تکثیر) ، آغازگرهای الیگونوکلئوتیدی (16-25 نوکلئوتید کوتاه مدت پلی نوکلئوتید مکمل ناحیه DNA برای تکثیر) ، dNTP ها (تری فسفاتهای دی اکسیریبونوکلئوتید) ، محلول بافر (pH محلول نمکی که شرایط فیزیکی مانند MgCl2 (فاکتور فاکتور آنزیم Mg + 2 کاتیون است) ، آنزیم آب و DNA پلیمراز را تنظیم می کند که روند تکثیر را تنظیم می کند. آنزیم DNA پلی مراز در برابر گرما بسیار مقاوم است و فرآیند تقویت را در شرایط آزمایشگاهی امکان پذیر می کند. آنزیم را می توان از باکتری Thermus aquaticus یا به صورت نوترکیبی به عنوان آمپلیتاق بدست آورد.
یکی از مزایای روش PCR این است که آغازگرهای استفاده شده در واکنش مخصوص ناحیه DNA برای تقویت خواهد بود ، بنابراین DNA الگو نیازی به خالص یا ایزوتایپ ندارد. منطقه مربوطه را می توان از یک جامعه DNA ناهمگن سنتز کرد.
PCR به صورت پی در پی در دستگاهی به نام سیکلر حرارتی رخ می دهد (شکل 1). این مراحل عبارتند از:
دناتوراسیون: 45 ثانیه - 2 دقیقه در 94 یا 95 درجه سانتیگراد. این جداسازی فیزیکی دو زنجیره مکمل است که مولکول DNA را تشکیل می دهد. در شرایط in-vivo ، این فرآیند با استفاده از آنزیم ها و پروتئین های ویژه در سلول ها در دمای بدن انجام می شود.
اتصال آغازگرها (بازپخت): آغازگرهای مخصوص ناحیه DNA برای تقویت ، بسته به ویژگی های هر جفت آغازگر ، در دمای حدود 70-55 درجه سانتیگراد به مدت 45 ثانیه - 2 دقیقه. در یک بازه زمانی به ناحیه DNA مربوط متصل می شود که می تواند بین آنها متفاوت باشد
افزایش طول: در این مرحله ، آنزیم پلیمراز dNTP ها را به انتهای 3 'آغازگرها متصل می کند و مکمل رشته DNA است و تکثیر انجام می شود.
3 مرحله ذکر شده در بالا یک چرخه PCR است. پس از متوسط 30-40 چرخه ، تقریباً 2 میلیارد مولکول از یک مولکول DNA به دست می آید.
برخی از DNA به دست آمده بسته به فرایند انجام شده می تواند برای استفاده بعدی استفاده یا ذخیره شود.
PCR کاربردهای گسترده ای در دندانپزشکی دارد. به طور خلاصه ، این مناطق عبارتند از:
PCR در تشخیص میکروبیولوژیک
تشخیص عوامل بیماری زای دهان از نظر دوره درمان و زمان بسیار مهم است. کاملا مهم است اگرچه از تکنیک های مختلفی در شناسایی عوامل بیماری زا استفاده می شود ، اما بیشترین روش های ارجح ، روش های بیولوژیکی مولکولی است زیرا به طور کلی حساس ترند. مطالعات فرهنگی برای تشخیص تقریباً 103-105 میکروارگانیسم لازم است. این اجازه می دهد تا 102-104 سلول را با روش های ترکیبی ایمونولوژیک یا DNA-DNA شناسایی کنید. با PCR ، 1-10 میکروارگانیسم برای تشخیص کافی است.
یکی از مزایای PCR سهولت در تشخیص بیماریزا در مناطقی است که تعداد میکروارگانیسم ها کم است. به دست آوردن مواد بیولوژیکی از مناطق دهانی ، به ویژه از جیب های تشکیل شده در لثه ، همیشه آسان نیست ، اما دستیابی به میکروارگانیسم های کافی برای تشخیص همیشه ممکن نیست. با روشهای مختلف PCR چنین مشکلاتی برطرف شده است.
هنگام مقایسه محیط کشت و PCR ، دشواری ، زمان بر بودن و هزینه محیط کشت بیشتر از PCR است.
روشهای مبتنی بر PCR نه تنها در برابر باکتریها بلکه در تشخیص عفونتهای قارچی و ویروسی در بافتهای دهان نیز ترجیح داده می شوند. Perra و Slots با استفاده از RT-PCR شیوع سیتومگالوویروس انسانی ، EBV 1 و 2 و HIV را از مایع ناحیه دهان گزارش کردند. با همین روش ، گارلر (2003) كیموكین ، گیرنده های كیموكین و میزان بیان سیتوكین را از بیوپسی های لثه (لثه) در بیماران مبتلا به پریدینیت تهاجمی و پریدینیت مزمن بررسی كرد.
سروتیپ ها و کلون های Saorela S. mutans و S. sobrinosum با روش AP-PCR مقایسه شدند.
روپف حضور S. mutans را از 16 كودك مبتلا به پوسیدگی دندان با روش PCR بررسی كرد و نشان داد كه PCR از محیط کشت انتخابی دارای مزیت بیشتری است.
اساس مولکولی اختلالات عاج و مینا
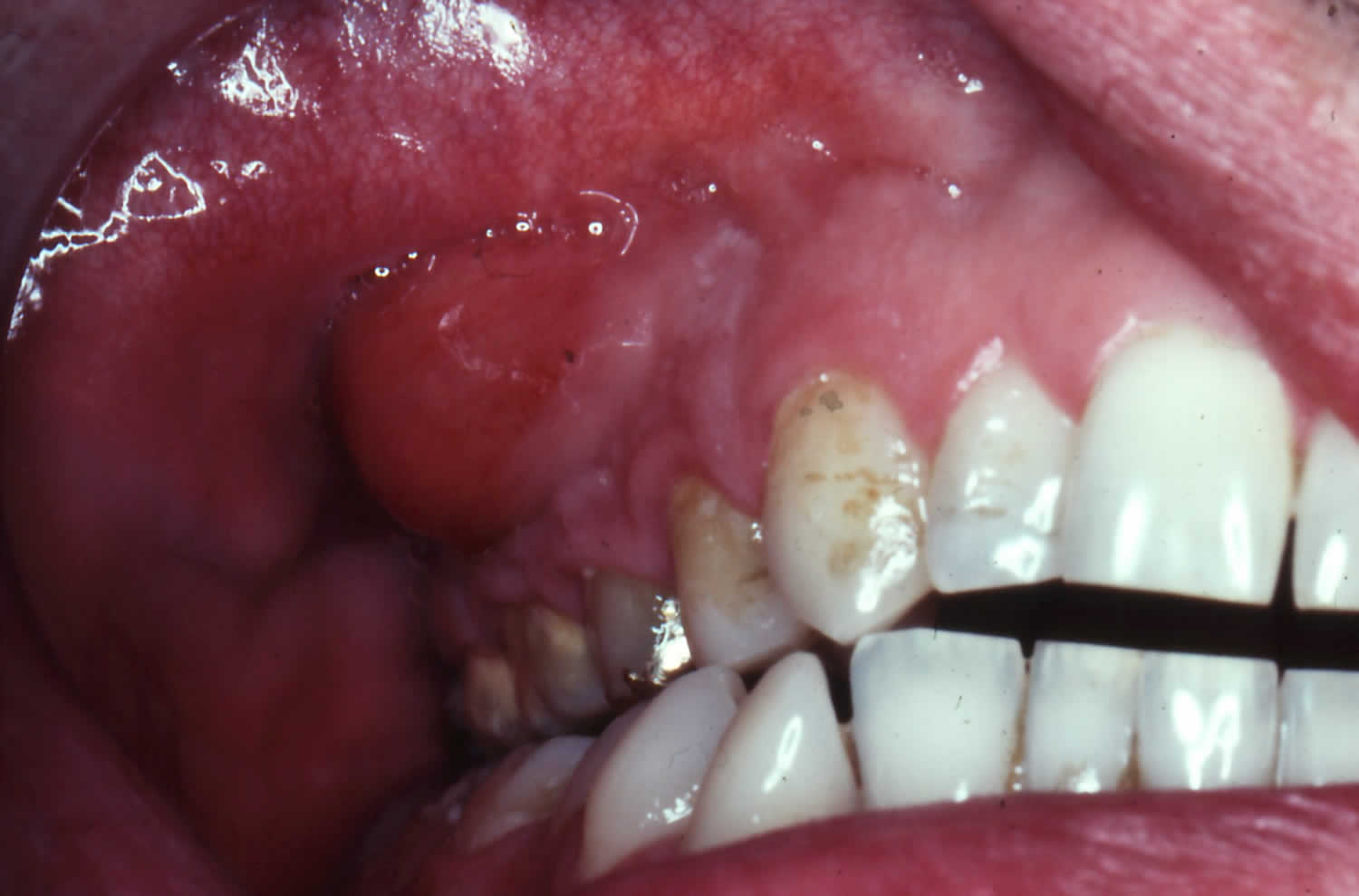
دنتینوژنز ایمپرفکتا (شکل 3) یک بیماری شایع تشکیل عاج است. مطالعات زیادی بر روی ژن ها یا گروه های ژنی عامل ایجاد این اختلال انجام شده است. تجزیه و تحلیل جهش را می توان با RFLP یا مطالعات تجزیه و تحلیل توالی پس از تقویت PCR معمولی انجام داد.
با همان روش ، مکانیسم های مولکولی اختلالات مینای دندان شروع به روشن شدن کرده و تحقیقات با سرعت کامل ادامه دارد.
شناسایی مبانی اختلالات رشد
شکاف کام - لب یکی از رایج ترین نقایص مادرزادی است. شکل گیری این ناهنجاری ها چند عاملی است ، هم عوامل محیطی و هم عوامل ژنتیکی موثر هستند. رابطه بین عوامل ژنتیکی و نقایص فنوتیپی که ممکن است رخ دهد با جستجوی بسیاری از ژن های نامزد ادامه دارد.
سرطان های بافت دهان
اگرچه سرطان های بافت دهان شیوع بالایی در بین همه سرطان ها ندارند ، اما از جمله انواع سرطانی هستند که باید مورد توجه قرار گیرند. هنگامی که ما به مبنای ژنتیکی نگاه می کنیم ، بسیاری از تجزیه و تحلیل های جهش در مورد سرطان های بافت دهان ، که منشا he ناهمگنی دارند ، انجام شده است و تجزیه و تحلیل عملکرد ژن های مرتبط همچنان بررسی می شود. هم ژنهای آنكوژن و هم سرکوب كننده تومور همچنان مورد تجزیه و تحلیل قرار می گیرند.
یکی از رایج ترین روش هایی که برای تشخیص جهش های ژنی استفاده می شود ، تجزیه و تحلیل توالی PCR است. با این حال ، در مطالعات با هدف شناسایی محصول ژنی از اهمیت بالایی برخوردار است. لی با استفاده از روش RT-PCR سطح بیان تلومراز افراد سالم مرتبط با کارسینوم سلول سنگفرشی دهانی را بررسی کرد و تأکید کرد که بیان HTERT یک نشانگر مهم برای سرطان است.
در آوریل 2001 ، دانشگاه اوکلاهما اعلام کرد که توالی ژن استرپتوکوکوس پیوژنز بیماریزا را تکمیل کرده است ، بنابراین فعالیتهای سلولی این پاتوژن و مشکلاتی که ممکن است در بافتهای دهان ایجاد کند بهتر قابل درک هستند. در عین حال ، توسعه سیستم های درمانی موثر علیه عاملی که می توان عوامل تعیین کننده بیماریزایی آن را توضیح داد و اینکه مشکلی اساسی در ارگانیسم میزبان ایجاد نخواهد کرد ، از مزایای رمزگشایی ارگانیسم بیماریزا است. بهترین نمونه از این روش درمانی ، STI-571 (Novartis) است که در سرطان مزمن میلید استفاده می شود. در نتیجه استفاده 6 ماهه از افراد در مرحله اول بیماری ، 90 درصد بیماران به دارو پاسخ مثبت می دهند.
در ربع قرن آینده ، از روش ها و رویکردهای جدید در درمان بیماری های دهان استفاده می شود. اولین مورد از این روش ها بازسازی بدن است. به عنوان مثال ، در درمان های ریشه ، به جای قرار دادن یک ماده خارجی روی ریشه دندان ، بافت لثه اصلاح شده ژنتیکی در آن ناحیه قرار می گیرد و در آن ناحیه بافت دهان تشکیل می شود. در مطالعه ای که در دانشگاه میشیگان روی این موضوع انجام شد ، با دستکاری های ژنتیکی ، بافت استخوانی از پوست و لثه ایجاد شد. بعلاوه ، برنامه ریزی شده است که مواد بیولوژیکی و ساختارهای دندانی در 25 سال آینده در برابر بیماری ها و میکروارگانیسم ها مقاوم باشند.
برنامه های اساسی PCR در دندانپزشکی
وقتی جزئیات اصلی پروژه ژنوم انسانی در فوریه 2001 (کنسرسیوم بین المللی و سلومر ژنومیکس) اعلام شد ، شکی نیست که باعث طنین و هیجان زیادی در سراسر جهان شد. به گفته بسیاری از دانشمندان ، اتمام این پروژه به معنی پایان بسیاری از بیماری ها ، جلوگیری از بیماری هایی مانند سرطان و ایدز ، یا خلاص شدن از شر بیماری هایی مانند سرطان ، طولانی شدن عمر انسان و افزایش کیفیت زندگی بود.
هنگامی که جزئیات اصلی پروژه ژنوم انسانی در فوریه 2001 (کنسرسیوم بین المللی و سلومر ژنومیکس) اعلام شد ، شکی نیست که باعث طنین و هیجان زیادی در سراسر جهان شد. به گفته بسیاری از دانشمندان ، اتمام این پروژه به معنی پایان بسیاری از بیماری ها ، جلوگیری از بیماری هایی مانند سرطان و ایدز ، یا خلاص شدن از شر بیماری هایی مانند سرطان ، طولانی شدن عمر انسان و افزایش کیفیت زندگی بود. با این حال ، هنگامی که این پروژه با طرح کلی آن نهایی شد ، درک شد که مراحل بیشتری وجود دارد که باید از آن عبور کرد. با وجود کار روزمره ، ژنوم انسان همچنان راز خود را حفظ می کند.
پروژه ژنوم انسانی تاکنون گسترش های زیادی داشته است. یکی از آنها رمزگشایی از ژنوم موجودات زنده دیگر است که می تواند به عنوان الگویی برای ژنوم انسان و انجام تجزیه و تحلیل عملکردی ژن های مشترک یا قسمت های مشترک ژن ها باشد. بنابراین ، بدون نیاز به مطالعات کشت سلولی ، که امروزه نیز مورد بحث قرار می گیرد ، شاید تجزیه و تحلیل ژن ها با حفظ سیستم بیولوژیکی موجودات زنده بر روی این موجودات نمونه ارائه شود. برای این منظور ، تاکنون تجزیه و تحلیل ژنوم از گونه های مختلف مانند H. آنفلوانزا ، S. cerevisiae ، C. elegans ، D. melanogaster ، M. musculus انجام شده است.
ارتباط بین ژن ها و بیماری ها طیف گسترده ای از مطالعات را نه تنها در پزشکی و زیست شناسی ، بلکه در همه زمینه های علوم بهداشتی ایجاد کرده است.
پروژه ژنوم انسانی که از نظر بودجه پیشتاز کارهایی است که تاکنون انجام شده است ، همچنین به توسعه تکنیک های جدید مولکولی کمک کرده است که می تواند به نتایج جدید و دقیق تری منجر شود.
واکنش زنجیره ای پلیمراز (PCR)
PCR توسط كاری مولیس در سال 1983 ساخته شد و با كشف وی جایزه نوبل شیمی در سال 1993 به وی اعطا شد. سایکی و همکاران در سال 1985 ، آنها اولین انتشارات خود را با استفاده از این روش انجام دادند. از روز انتشار ، این روش در مطالعات مبتنی بر DNA یا RNA ، به ویژه در زمینه های زیست شناسی مولکولی ، ژنتیک ، پزشکی ، پزشکی قانونی و شیمی مورد استفاده قرار گرفته است و به تعداد باورنکردنی 90 مقاله در روز رسیده است ( 1)
روش PCR تکثیر (تقویت) DNA در شرایط آزمایشگاهی است. در عین حال ، سنتز DNA از مولکول RNA در شرایط خاص به راحتی قابل استفاده است. اجزای مورد نیاز در این زنجیره واکنش ها عبارتند از: DNA الگو (مولکول DNA برای تکثیر) ، آغازگرهای الیگونوکلئوتیدی (16-25 نوکلئوتید کوتاه مدت پلی نوکلئوتید مکمل ناحیه DNA برای تکثیر) ، dNTP ها (تری فسفاتهای دی اکسیریبونوکلئوتید) ، محلول بافر (pH محلول نمکی که شرایط فیزیکی مانند MgCl2 (فاکتور فاکتور آنزیم Mg + 2 کاتیون است) ، آنزیم آب و DNA پلیمراز را تنظیم می کند که روند تکثیر را تنظیم می کند. آنزیم DNA پلی مراز در برابر گرما بسیار مقاوم است و فرآیند تقویت را در شرایط آزمایشگاهی امکان پذیر می کند. آنزیم را می توان از باکتری Thermus aquaticus یا به صورت نوترکیبی به عنوان آمپلیتاق بدست آورد.
یکی از مزایای روش PCR این است که آغازگرهای استفاده شده در واکنش مخصوص ناحیه DNA برای تقویت خواهد بود ، بنابراین DNA الگو نیازی به خالص یا ایزوتایپ ندارد. منطقه مربوطه را می توان از یک جامعه DNA ناهمگن سنتز کرد.
PCR به صورت پی در پی در دستگاهی به نام سیکلر حرارتی رخ می دهد (شکل 1). این مراحل عبارتند از:
دناتوراسیون: 45 ثانیه - 2 دقیقه در 94 یا 95 درجه سانتیگراد. این جداسازی فیزیکی دو زنجیره مکمل است که مولکول DNA را تشکیل می دهد. در شرایط in-vivo ، این فرآیند با استفاده از آنزیم ها و پروتئین های ویژه در سلول ها در دمای بدن انجام می شود.
اتصال آغازگرها (بازپخت): آغازگرهای مخصوص ناحیه DNA برای تقویت ، بسته به ویژگی های هر جفت آغازگر ، در دمای حدود 70-55 درجه سانتیگراد به مدت 45 ثانیه - 2 دقیقه. در یک بازه زمانی به ناحیه DNA مربوط متصل می شود که می تواند بین آنها متفاوت باشد
افزایش طول: در این مرحله ، آنزیم پلیمراز dNTP ها را به انتهای 3 'آغازگرها متصل می کند و مکمل رشته DNA است و تکثیر انجام می شود.
3 مرحله ذکر شده در بالا یک چرخه PCR است. پس از متوسط 30-40 چرخه ، تقریباً 2 میلیارد مولکول از یک مولکول DNA به دست می آید.
برخی از DNA به دست آمده بسته به فرایند انجام شده می تواند برای استفاده بعدی استفاده یا ذخیره شود.
PCR کاربردهای گسترده ای در دندانپزشکی دارد. به طور خلاصه ، این مناطق عبارتند از:
PCR در تشخیص میکروبیولوژیک
تشخیص عوامل بیماری زای دهان از نظر دوره درمان و زمان بسیار مهم است. کاملا مهم است اگرچه از تکنیک های مختلفی در شناسایی عوامل بیماری زا استفاده می شود ، اما بیشترین روش های ارجح ، روش های بیولوژیکی مولکولی است زیرا به طور کلی حساس ترند. مطالعات فرهنگی برای تشخیص تقریباً 103-105 میکروارگانیسم لازم است. این اجازه می دهد تا 102-104 سلول را با روش های ترکیبی ایمونولوژیک یا DNA-DNA شناسایی کنید. با PCR ، 1-10 میکروارگانیسم برای تشخیص کافی است.
یکی از مزایای PCR سهولت در تشخیص بیماریزا در مناطقی است که تعداد میکروارگانیسم ها کم است. به دست آوردن مواد بیولوژیکی از مناطق دهانی ، به ویژه از جیب های تشکیل شده در لثه ، همیشه آسان نیست ، اما دستیابی به میکروارگانیسم های کافی برای تشخیص همیشه ممکن نیست. با روشهای مختلف PCR چنین مشکلاتی برطرف شده است.
هنگام مقایسه محیط کشت و PCR ، دشواری ، زمان بر بودن و هزینه محیط کشت بیشتر از PCR است.
روشهای مبتنی بر PCR نه تنها در برابر باکتریها بلکه در تشخیص عفونتهای قارچی و ویروسی در بافتهای دهان نیز ترجیح داده می شوند. Perra و Slots با استفاده از RT-PCR شیوع سیتومگالوویروس انسانی ، EBV 1 و 2 و HIV را از مایع ناحیه دهان گزارش کردند. با همین روش ، گارلر (2003) كیموكین ، گیرنده های كیموكین و میزان بیان سیتوكین را از بیوپسی های لثه (لثه) در بیماران مبتلا به پریدینیت تهاجمی و پریدینیت مزمن بررسی كرد.
سروتیپ ها و کلون های Saorela S. mutans و S. sobrinosum با روش AP-PCR مقایسه شدند.
روپف حضور S. mutans را از 16 كودك مبتلا به پوسیدگی دندان با روش PCR بررسی كرد و نشان داد كه PCR از محیط کشت انتخابی دارای مزیت بیشتری است.
اساس مولکولی اختلالات عاج و مینا
دنتینوژنز ایمپرفکتا (شکل 3) یک بیماری شایع تشکیل عاج است. مطالعات زیادی بر روی ژن ها یا گروه های ژنی عامل ایجاد این اختلال انجام شده است. تجزیه و تحلیل جهش را می توان با RFLP یا مطالعات تجزیه و تحلیل توالی پس از تقویت PCR معمولی انجام داد.
با همان روش ، مکانیسم های مولکولی اختلالات مینای دندان شروع به روشن شدن کرده و تحقیقات با سرعت کامل ادامه دارد.
شناسایی مبانی اختلالات رشد
شکاف کام - لب یکی از رایج ترین نقایص مادرزادی است. شکل گیری این ناهنجاری ها چند عاملی است ، هم عوامل محیطی و هم عوامل ژنتیکی موثر هستند. رابطه بین عوامل ژنتیکی و نقایص فنوتیپی که ممکن است رخ دهد با جستجوی بسیاری از ژن های نامزد ادامه دارد.
سرطان های بافت دهان
اگرچه سرطان های بافت دهان شیوع بالایی در بین همه سرطان ها ندارند ، اما از جمله انواع سرطانی هستند که باید مورد توجه قرار گیرند. هنگامی که ما به مبنای ژنتیکی نگاه می کنیم ، بسیاری از تجزیه و تحلیل های جهش در مورد سرطان های بافت دهان ، که منشا he ناهمگنی دارند ، انجام شده است و تجزیه و تحلیل عملکرد ژن های مرتبط همچنان بررسی می شود. هم ژنهای آنكوژن و هم سرکوب كننده تومور همچنان مورد تجزیه و تحلیل قرار می گیرند.
یکی از رایج ترین روش هایی که برای تشخیص جهش های ژنی استفاده می شود ، تجزیه و تحلیل توالی PCR است. با این حال ، در مطالعات با هدف شناسایی محصول ژنی از اهمیت بالایی برخوردار است. لی با استفاده از روش RT-PCR سطح بیان تلومراز افراد سالم مرتبط با کارسینوم سلول سنگفرشی دهانی را بررسی کرد و تأکید کرد که بیان HTERT یک نشانگر مهم برای سرطان است.
در آوریل 2001 ، دانشگاه اوکلاهما اعلام کرد که توالی ژن استرپتوکوکوس پیوژنز بیماریزا را تکمیل کرده است ، بنابراین فعالیتهای سلولی این پاتوژن و مشکلاتی که ممکن است در بافتهای دهان ایجاد کند بهتر قابل درک هستند. در عین حال ، توسعه سیستم های درمانی موثر علیه عاملی که می توان عوامل تعیین کننده بیماریزایی آن را توضیح داد و اینکه مشکلی اساسی در ارگانیسم میزبان ایجاد نخواهد کرد ، از مزایای رمزگشایی ارگانیسم بیماریزا است. بهترین نمونه از این روش درمانی ، STI-571 (Novartis) است که در سرطان مزمن میلید استفاده می شود. در نتیجه استفاده 6 ماهه از افراد در مرحله اول بیماری ، 90 درصد بیماران به دارو پاسخ مثبت می دهند.
در ربع قرن آینده ، از روش ها و رویکردهای جدید در درمان بیماری های دهان استفاده می شود. اولین مورد از این روش ها بازسازی بدن است. به عنوان مثال ، در درمان های ریشه ، به جای قرار دادن یک ماده خارجی روی ریشه دندان ، بافت لثه اصلاح شده ژنتیکی در آن ناحیه قرار می گیرد و در آن ناحیه بافت دهان تشکیل می شود. در مطالعه ای که در دانشگاه میشیگان روی این موضوع انجام شد ، با دستکاری های ژنتیکی ، بافت استخوانی از پوست و لثه ایجاد شد. بعلاوه ، برنامه ریزی شده است که مواد بیولوژیکی و ساختارهای دندانی در 25 سال آینده در برابر بیماری ها و میکروارگانیسم ها مقاوم باشند.



.jpg)